
Výukové materiály ZŠ Kaplice, Školní 226

prvky |
soustava |
vazba |
látek |
příklady |
|---|
Asi tři čtvrtiny všech prvků jsou kovy. V přírodě se nejčastěji vyskytují ve sloučeninách. V kovech jsou atomy těsně uspořádány v pravidelné struktuře.
Rozlišuje se 7 krystalových soustav:
- trojklonná, jednoklonná, kosočtverečná, čtverečná, krychlová, šesterečná a klencová.
Těsné uspořádání způsobuje, že se elektrony valenční vrstvy odpoutávají od svých atomů, a vzniká tak iontová mřížka, v níž se mezi jednotlivými kladně nabitými ionty kovů pohybují volné elektrony.
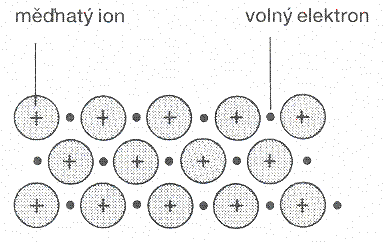
obr. Animovaná chemie - CD
Kationty mědi jsou ve svých polohách udržovány zápornými náboji volně pohyblivých valenčních elektronů.
Vlastnosti kovů
a) fyzikální - jsou to ty vlastnosti, při kterých se látka nemění na jinou látku
- 1. Kovy jsou za běžných podmínek pevné látky kromě rtuti.
- 2. Jsou odolné vůči nárazům. Mají vysokou pevnost v tlaku a v tahu.
- 3. S použitím dostatečné síly se většina kovů dá ohýbat nebo jinak tvarovat. Jsou kujné a tažné. Lze z nich táhnout dráty. Vrstvy iontů se mohou vůči sobě posouvat bez porušení kovové vazby.
- 4. Protože atomy mají těsné uspořádání, jsou kovy většinou "těžké" neboli mají většinou velkou hustotu - olovo. Hliník je naopak lehký.
- 5. Kovy jsou dobrými vodiči elektrického proudu, protože elektrony nesoucí náboj se mohou volně pohybovat uvnitř mřížky
- 6. Kovy jsou dobrými vodiči tepla. Volné elektrony přenášejí tepelnou energii.
- 7. Kovy mají většinou vysoké teploty tání, protože porušení silné kovové vazby vyžaduje dodání velkého množství tepelné energie. Měď taje při 10830C.
Ovšem kovy 1. skupiny mají nízké teploty tání (pro sodík je teplota tání 980C a rtuť je kapalná už při laboratorní teplotě).- 8. Kovy rezonují. Úderem se zvonivě rozezní.
- 9. Po vyleštění jsou kovy lesklé.
b) chemické vlastnosti - tykají se chemických změn kovů.
- 1. Kovy tvoří snadno kladné ionty (kationty),(snadno předávají valenční elektrony).
- Ca - 2e ---> Ca2+
- 2. Reagují s nekovy: s kyslíkem za vzniku oxidů
- 2Mg + O2 ---> 2MgO
- 3. Reagují s vodou: 2Na + 2H2O ---> 2NaOH + H2
- 4. Na povrchu kovů probíhají pomalé změny vlivem vnějších podmínek -koroze
Řada reaktivity kovů

nejreaktivnější nejméně reaktivní
Rozdělení kovů
a) podle hustoty: lehké - Na, Mg; těžké - Fe, Cu, Pb, b) podle ceny a vzácnosti: dráhé - Ag, Au, Pt a ostatní c) podle stálosti (reaktivnosti) na vzduchu: neušlechtilé - ušlechtilé
Skupiny kovů v periodické tabulce
- Alkalické kovy: Li, Na, K, Rb, Cs, Fr
- Kovy alkalických zemin: Be, Mg, Ca, Sr, Ba, Ra
- Přechodné kovy:
- - Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
- - Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
- - Lu, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
- Ušlechtilé kovy: Cu, Ag, Au, Hg, Ru, Rh, Pd, Re, Os, Ir, Pt
- Kovy skupiny železa: Fe, Co, Ni
- Platinové kovy: lehké: Ru, Rh, Pd; těžké: Os, Ir, Pt
- Lanthanoidy
- Aktinoidy
Slitiny kovů
- se připravují tuhnutím roztavených směsí kovů (mají pro určité použití lepší vlastnosti)
Př.
bronz - Cu + Sn: lépe se slévá než čistá měď a je tvrdší ocel - Fe + jiné kovy : pevnější , pružnější, méně koroduje pájky - Pb + Sn + Sb: nízká teplota taní, užití k pájení kovů dural - Al + Mg + Mn + Cu: tvrdší a pevnější než čistý hliník mosaz - Cu + Zn: vhodná na lisování, válcování