
Výukové materiály ZŠ Kaplice, Školní 226

prvky |
soustava |
vazba |
látek |
příklady |
|---|
Složení látek
1. Popiš stavbu atomu. Popiš složení atomu vodíku (uhlíku, sodíku). Čím se od sebe liší protony, elektrony a neutrony? Proč je atom elektricky neutrální i když obsahuje elektricky nabité částice?
2. Urči počty protonů a elektronů v atomu, znáš-li protonové číslo, značku nebo název chemického prvku.
3. Zapiš chemickým vzorcem látky tvořené: dvěma atomy kyslíku a jedním atomem síry, jedním atomem dusíku a třemi atomy vodíku, třemi atomy kyslíku, dvěma atomy vodíku a jedním atomem kyslíku.
4. Uveď příklady molekul tvořených dvěma stejnými atomy (dvěma různými atomy, třemi atomy, čtyřmi atomy).
5. Z množiny látek vyber ty, které patří mezi sloučeniny: voda, vodík, kyslík, ozon, chlor, kuchyňská sůl.
6. Ze vzorců chemických látek vyber ty, které představují sloučeniny: H2O, CO2, O3, NH3, CH4, H2.
7. Vysvětli, co znamená zápis: P4, O2, 5H2O, 3O, O3.
8. Zapiš značkami a vzorci: dvě molekuly vodíku, tři atomy dusíku, pět molekul vody, molekulu vodíku.
9. Jak vzniká z neutrálního atomu kation (anion)?
10. Zapiš chemickou rovnicí vznik těchto částic z neutrálních atomů: F-, Mg2+, Na+, S2-, Al3+.
11. Urči počty protonů a elektronů tvořících tyto částice: K+, O, O2-, Ca2+, Cl-.
Jak se nazývá částice látky, která obsahuje 11 protonů a 10 elektronů (34 elektronů a 32 protonů, 13 protonů a 10 elektronů)? Vyjádři ji chemickými symboly.
12. Z hodnot elektronegativit prvků urči typ chemické vazby v těchto látkách: HCl, N2, H2O, KCl.
13. Přiřaď správně pojmy: atom, prvek, molekula, kation, anion, směs, sloučenina.
Látky rozdělujeme na ........
Mezi částice látek patří.......
14. Uvedené látky roztřiď na chemické prvky, chemické sloučeniny, směsi: voda, minerální voda, vodík, kyslík, chlor, chlorovodík, led, roztok kuchyňské soli.
15. Protony jsou obsaženy:a) v atomových jádrech ano ne b) v aniontech ano ne c) ve vodě ano ne d) ve vzduchu ano ne
16. Atom vápníku má protonové číslo 20. Kation vápníku Ca2+ obsahuje v elektronovém obalu:
A. 22 elektronů B. 21 elektronů C. 20 elektronů D. 18 elektronů
17. Zápis Ca2+ označuje:A. kation B. anion C. sloučeninu D. molekulu E. prvek
18. Chemická vazba vzniká:
A. spojením protonů ze dvou atomů B. spojením neutronů ze dvou atomů C. spojením dvou atomových jader D. vytvářením elektronového páru mezi atomy E. jinak než uvádějí výše uvedené případy
19. Doplňte správně čísla ve větě.
5 molekul vody obsahuje celkem
a) ........ atomů vodíku b) ........ atomů kyslíku c) ......... atomů dusíku
20. Látkou, která se skládá z atomů o stejném protonovém čísle je:
A. vzduch B. zlato C. chlorovodík D. oxid uhličitý
21. Ve čtyřech nádobách jsou obsaženy látky, jejichž modely molekul jsou schematicky znázorněny na obrázcích.
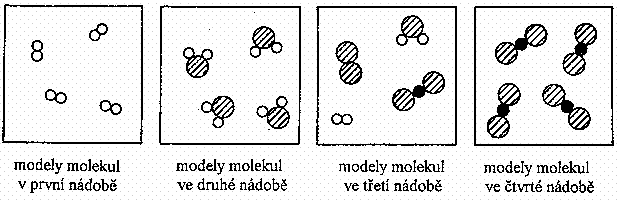
Vyber správnou odpověď:
DVĚ z nádob obsahují:
A. chemické prvky B. chemické sloučeniny C. směsi D. roztoky
22. Fluorid vápenatý CaF2 se nachází v přírodě jako minerál kazivec. Je to iontová sloučenina, která obsahuje ionty Ca2+ a F-. Kousek kazivce
A. má náboj kladný B. nemá elektrický náboj C. má náboj záporný D. má na jednom konci náboj kladný a na druhém záporný
Chemické prvky
nahoru
1. Uveď příklady kovů lehkých, ušlechtilých, drahých.
2. Odliš od sebe podle charakteristických vlastností tyto kovy: železo a hliník, měď a olovo, platinu a hořčík, zlato a stříbro.
3. Ze značek prvků vyber značky kovů a uveď alespoň tři příklady jejich využití. Na, Cl, Fe, Pb, H, Si, Al, O, Ge, Ne, Au, Ar, Ca, He, Zn, Cu, C
4. Které kovové prvky nebo slitiny se používají k výrobě vodičů, šperků, stavebních konstrukcí, stavbě letadel, pájení kovů, výrobě vláken do žárovek, ochraně ocelí před korozí?
5. Ze značek prvků vyber značky nekovů. Na, Cl, Fe, Pb, H, Si, Al, O, Ge, N, Au, Ar, C, He, P
6. Jmenuj příklady nekovových prvků, které jsou známy v několika různých formách lišících se vlastnostmi.
7. Uveď alespoň tři společné vlastnosti halogenů.
8. Chlor patří mezi nejdůležitější chemické látky. Uveď příklady použití chloru a jeho sloučenin. Jaké nebezpečí hrozí při práci s chlorem a jak se mu dá předcházet?
9. Uveď alespoň tři příklady praktického využívání vodíku (kyslíku, síry, uhlíku).
10. Na vlastnostech železa a síry (sodíku a chloru) uveď hlavní rozdíly mezi kovy a nekovy.
11. V periodické soustavě prvků vyznač, kde jsou přibližně zařazeny kovy a kde nekovy.
12. Pomocí periodické soustavy prvků vyjmenuj prvky třetí periody (I. A skupiny, vzácné plyny).
13. Z dále uvedených prvků vyber a označ halogen (vzácný plyn, alkalický kov). Na, Cl, Fe, Pb, H, Si, Al, O, Ge, N, Au, Ar, C, He, P
14. Uveď, co mají společného prvky stejné skupiny (stejné periody) periodické soustavy.
15. Vyjmenuj prvky, které se svými vlastnostmi podobají bromu (vápníku, fosforu, kryptonu).
16. Proč se svými vlastnostmi podobají sodík a draslík (chlor a fluor, neon a argon)?
17. Kolik vnějších elektronů mají atomy síry (hořčíku, neonu)?