




INVESTICE DO ROZVOJE VZDĚLÁVÁNÍ
Výukové materiály ZŠ Kaplice, Školní 226





Třídění uhlovodíků
Uhlovodíky jsou dvouprvkové organické sloučeniny uhlíku a vodíku.
nahoru
Alkany
Alkany byly dříve nazývány parafíny (podle latinského parum affinis = málo slučivý), protože byly považovány za málo reaktivní.

obr. Chemie na každém kroku, Nakl. MOBY DICK, Praha
Definice
Alkany jsou uhlovodíky, které mají v otevřeném uhlíkatém řetězci mezi atomy uhlíku pouze jednoduché vazby.
Obecný vzorec alkanů: CnH2n+2
n - přirozené číslo, které vyjadřuje počet atomů uhlíku v molekule
Názvosloví
Názvy alkanů mají zakončení -an.
Název prvních čtyř alkanů je třeba si zapamatovat!
Pro názvy následujících alkanů se kromě již zmíněného zakončení používají předpony odpovídající počtu atomů uhlíku.
Příklady
Název n Strukturní
vzorecRacionální
vzorecMolekulový
vzorecTeplota
tání 0CTeplota
varu 0Cmethan 1 CH4 CH4 -183 -161 ethan 2 CH3-CH3; (CH3)2 C2H6 -172 -88 propan 3 CH3-CH2-CH3 C3H8 -189 -42 butan 4 CH3(CH2)2CH3 C4H10 -138 -0,5 pentan 5 CH3(CH2)3CH3 C5H12 -130 36 hexan 6 CH3(CH2)4CH3 C6H14 -94 69 heptan 7 CH3(CH2)5CH3 C7H16 -91 98 oktan 8 CH3(CH2)6CH3 C8H18 -56 125 nonan 9 CH3(CH2)7CH3 C9H20 dekan 10 CH3(CH2)8CH3 C10H22
Každý následující uhlovodík se liší od předchozího přírůstkem skupiny atomů -CH2-. Takové řady uhlovodíků mají název homologické (z řeckého slova homologie, tj. shoda). Látky v těchto řadách mají podobné vlastnosti.
Fyzikální vlastnosti
- alkany C1 až C4 jsou plyny, C5 až C16 jsou kapaliny, C16 a vyšší jsou pevné látky
- alkany jsou nerozpustné ve vodě, bezbarvé, rozpouštějí se v organických rozpouštědlech, samy rozpouštějí některé organické látky (tuky, oleje)
Chemické vlastnosti
- alkany hoří za vzniku oxidu uhličitého a vody
spalování: CH4 + 2O2 ---> CO2 + 2H2O + teplo
Zástupci
Methan CH4

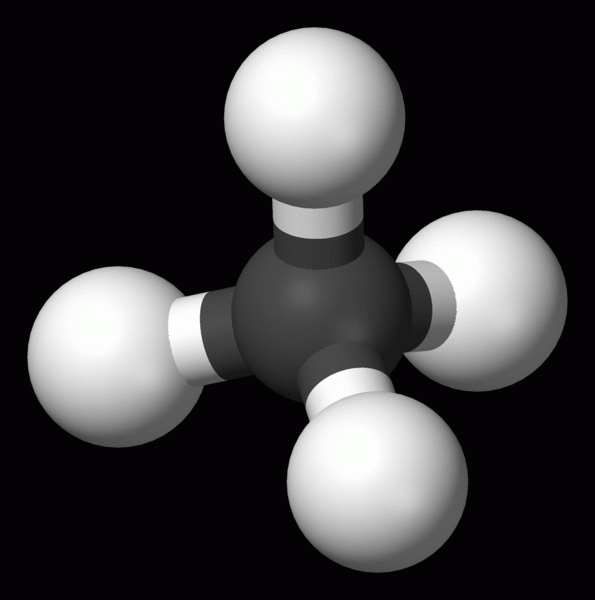
obr. wikipedia.cz
- bezbarvá, plynná, hořlavá látka
- hlavní složka zemního plynu, bahenního plynu a bioplynu
- se vzduchem může vytvářet výbušnou směs
- používá se jako palivo v domácnostech i průmyslu, chemická surovina pro výrobu vodíku, sází, acetylenu aj.
Ethan C2H6
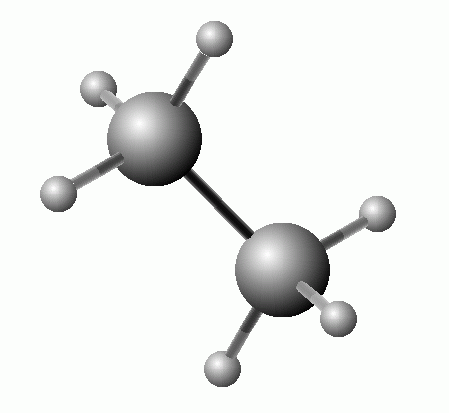
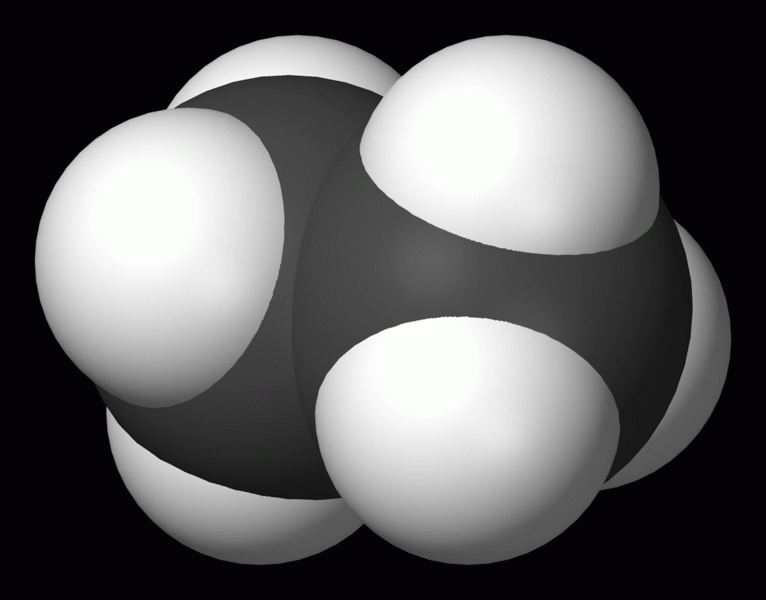
obr. wikipedie.cz
- bezbarvá, plynná, hořlavá látka, těžší než vzduch, součást zemního plynu
- používá se jako palivo v domácnostech i průmyslu, surovina pro získávání (syntézu) organických látek
Propan C3H8 a butan C4H10
- bezbarvé, plynné, hořlavé látky s větší hustotou než vzduch
- kapalná směs stlačená v ocelových láhvích se používá jako palivo v domácnostech, kde není zaveden zemní plyn, jako palivo do cestovních vařičů a do motorů aut
- při spalování vzniká voda a oxid uhličitý, a proto se jedná o ekologické palivo
- obě látky se snadno zkapalňují a v této podobě se převážejí a skladují. Nesmí se skladovat v uzavřených a sklepních prostorách!
- při smíchání se vzduchem je směs výbušná
Benziny
- jsou to směsi kapalných alkanů
- kvalita benzínu se hodnotí tzv. oktanovým číslem od nuly do sta. Nula přísluší heptanu číslo 100 isooktanu
Parafin
- je to směs pevných alkanů
- používá se k výrobě svíček a k impregnaci
nahoru
Cykloalkany
Definice
Cykloalkany jsou uhlovodíky, které mají v uzavřeném uhlíkatém řetězci mezi atomy uhlíku pouze jednoduché vazby.
Obecný vzorec cykloalkanů: CnH2n,
n - přirozené číslo, které vyjadřuje počet atomů uhlíku v molekule
Názvosloví
Název je tvořen jako u příslušného alkanu, pouze s předponou cyklo-
Příklady
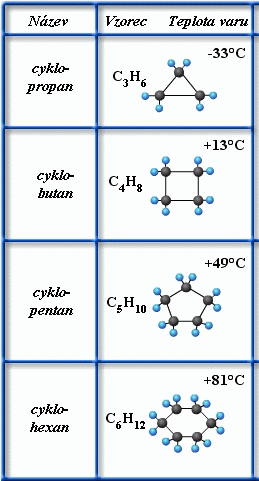
obr. Animovaná chemie - CD
Vlastnosti
- cykloalkany jsou poměrně málo reaktivní s výjimkou cyklopropanu a cyklobutanu, které se za určitých podmínek mění ve sloučeniny s otevřeným řetězcem.
Zástupci
Cyklopropan C3H6
- používá se např. v lékařství jako anestetikum
Cyklohexan C6H12
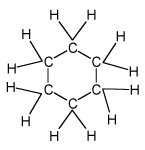
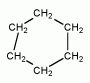
- kapalná, hořlavá látka získávaná z ropy
- používá se jako surovina pro výrobu plastů a jako rozpouštědlo
- dehydrogenací cyklohexanu vzniká benzen
- spalování: C6H12 + 9O2 ---> 6CO2 + 6H2O
nahoru
Alkeny
Definice
Alkeny jsou uhlovodíky, které mají v otevřeném uhlíkatém řetězci mezi atomy uhlíku jednu dvojnou vazbu.
Názvosloví
Názvy alkenů mají zakončení -en.
Obecný vzorec alkenů : CnH2n
n - přirozené číslo, které vyjadřuje počet atomů uhlíku v molekule
Příklady
Název n Strukturní vzorec Racionální vzorec Molekulový
vzorecModel
molekulyTeplota
varu 0Cethen
(ethylen)2 CH2=CH2 C2H4 -104 propen
(propylen)3 CH2=CH-CH3 C3H6 -47 But-1-en
(butyl-1-en)4 CH2=CH-CH2-CH3 C4H8 -6 pent-1-en 5 CH2=CH-CH2-CH2-CH3 C5H10 30
obr. Animovaná chemie - CD
Fyzikální vlastnosti
- svými fyzikálními vlastnostmi se podobají alkanům. Obvykle se od nich příliš neliší teplotou varu ani teplotou tání.
Chemické vlastnosti:
- jsou vzhledem ke své struktuře reaktivnější než alkany
- spalování: C2H4 + 3O2 ---> 2CO2 + 2H2O
- adice:
Adice je reakce, při níž se na organickou sloučeninu nesoucí násobnou vazbu adují (přidávají) molekuly jiné látky (např. vodík, voda) a násobná vazba zaniká.
CH2=CH2 + H2 ---> C2H6
- polymerace:
Polymerace je mnohokrát opakovaná adice (polyadice), při níž z monomeru (alkenu) vzniká polymer a zaniká dvojná vazba.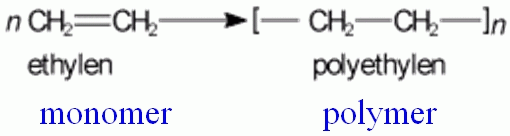
Zástupci
Ethen CH2=CH2
- lehký bezbarvý plyn nasládlé chuti, ve směsi se vzduchem vybuchuje
- získává se při zpracování ropy
- slouží k výrobě např. polyethylenu nebo ethanolu
Propen CH2=CH-CH3
- plyn
- získává se při zpracování ropy
- slouží k výrobě např. polypropylenu nebo acetonu
nahoru
Alkadieny
Definice
Alkadieny jsou uhlovodíky, které mají v otevřeném uhlíkatém řetězci mezi atomy uhlíku dvě dvojné vazby.
Názvosloví
Charakteristická koncovka alkadienů je - dien.
Obecný vzorec alkadienů : CnH2n-2
n - přirozené číslo, které vyjadřuje počet atomů uhlíku v molekule
Příklady
Molekulový
vzorecbut-1,3 -dien CH2=CH-CH=CH2 C4H6 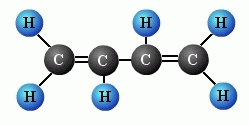
výroba syntetického kaučuku 2- methylbut-1,3-dien
(izopren)CH2=C(CH3)-CH=CH2 C5H8 výroba syntetického kaučuku
obr. Animovaná chemie - CD
nahoru
Alkyny
Definice
Alkyny jsou uhlovodíky, které mají v otevřeném uhlíkatém řetězci mezi atomy uhlíku jednu trojnou vazbu.
Názvosloví
Názvy alkynů mají zakončení-yn. (Jejich název je odvozen z názvu základního alkanu s příponou -yn).
Obecný vzorec alkynů : CnH2n-2
n - přirozené číslo, které vyjadřuje počet atomů uhlíku v molekule
Příklady
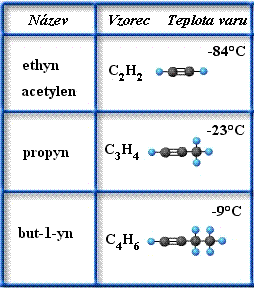
obr. Animovaná chemie - CD
Acetylen (ethyn)
obr. Animovaná chemie - CD
Příprava
CaC2 + 2H2O ---> C2H2 + Ca (OH)2
karbid
vápenatý
Vlastnosti
a) fyzikální
bezbarvá, plynná, hořlavá látka, která tvoří se vzduchem výbušnou směs
b) chemické
- adice
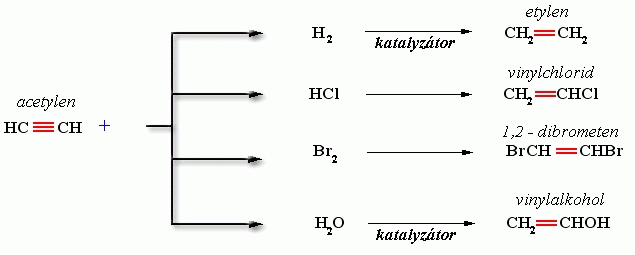
-hoření
2C2H2 + O2 ---> 4C + 2H2 O
Využití
surovina pro výrobu plastů (polyvinylchloridu - PVC), kyseliny octové atd. Kyslíkoacetylenový plamen se používá při svařování a řezání kovů - 3000°C.

obr. www.svarovani.navajo.cz
nahoru
Areny (aromatické uhlovodíky)
Definice
Areny jsou uhlovodíky, které v molekulách obsahují aspoň jedno benzenové jádro:
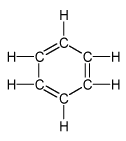
častěji se však používají tato grafická znázornění:
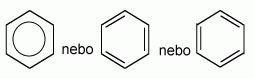
Struktura benzenu
Německý chemik českého původu F.A.Kekule předpokládal, že dvojné vazby v molekule jsou pohyblivé, a proto nemá benzen žádnou skutečně dvojnou vazbu. Tato teorie byla potvrzená měřením délky vazeb mezi atomy uhlíku (viz tabulka) a chemickým chováním benzenu.

obr. ustavchemie.sci.muni.cz
vazba délka vazby (nm) jednoduchá
(v molekule ethanu)0,154 nm aromatická
(v molekule benzenu)0,139 nm dvojná
(v molekule ethenu)0,134 nm trojná
(v molekule ethynu)0,124 nm
Dnes se pro benzen používá zvláštní strukturní vzorec, který vyjadřuje rovnoměrné rozdělení elektronů v jádře.
Názvosloví
V názvosloví arenů neexistují žádná pravidla jako například u alkanů, které mají svoji charakteristickou koncovku, proto si jejích názvy musíte pamatovat.
Zástupci
Název Strukturní vzorec Racionální vzorec Molekulový vzorec Vlastnosti Využití benzen C6H6 jedovatá, hořlavá,
bezbarvá kapalina s aromatickou vůní, jeho páry jsou karcinogennívýroba léčiv, plastů,
výbušnin, používá
se jako průmyslové
rozpouštědlonaftalen C10H8 bílá, krystalická, charakteristicky páchnoucí látka surovina pro výrobu barviv, repelent proti molům toluen C7H8 hořlavá kapalná látka, jejíž páry se vzduchem tvoří výbušnou směs; škodí zdraví běžně používané rozpouštědlo barev a laků, k výrobě vojenské trhaviny TNT styren C8H8 hořlavá kapalná látka výroba plastu polystyrenu