Výukové materiály ZŠ Kaplice, Školní 226

k anorganické chemii |
podle kyselosti |
příklady |
|---|
Některé látky se mohou vlivem prostředí (rozpouštědla) rozložit na ionty.
Př. rozložení molekuly vody na ionty:
H2O ---> H+ + OH-
2H2O ---> H3O+ + OH-
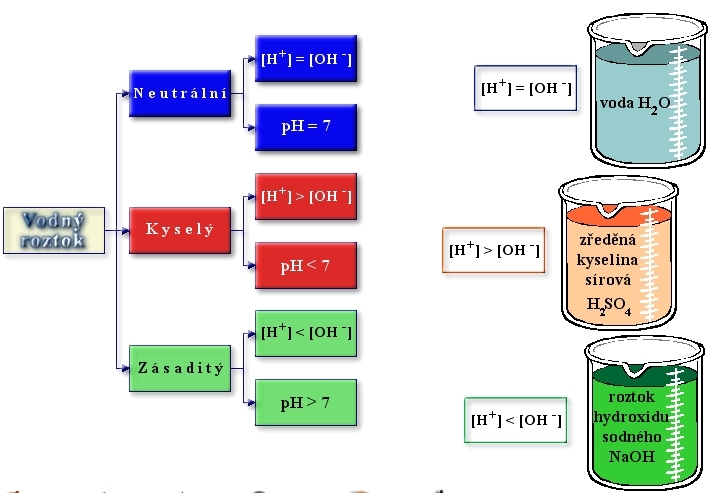
Vodíkový kation (přesněji oxoniový kation H3O+) způsobuje kyselost roztoku, hydroxidový anion OH- způsobuje zásaditost roztoku.
Jsou-li koncentrace obou iontů v roztoku stejné, je roztok neutrální.
Látky podle kyselosti dělíme na:
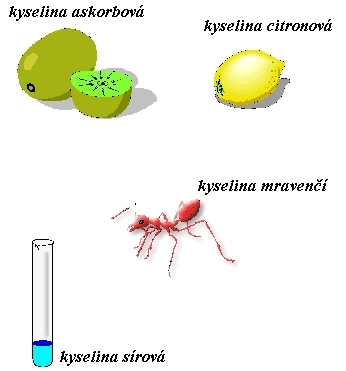
1. Kyseliny ( cH3O+ > cOH- ): ocet, kyselina chlorovodíková
obr. Animovaná chemie - CD
2. Neutrální ( cH3O+ = cOH- ): destilovaná voda
3. Zásady (hydroxidy) ( cH3O+ < cOH- ): mýdlo, čisticí prostředky, hydroxid sodný
obr. Animovaná chemie - CD
Orientačně kyselost a zásaditost roztoků zjišťujeme barevnými indikátory (lakmus, fenolftalein), přesně je určujeme pomocí hodnot pH.
Indikátory jsou látky, které se změnou kyselosti (nebo zásaditosti) mění své zbarvení a umožňují důkaz přítomnosti určitých látek.
indikátor/zabarvení kyselý roztok neutrální roztok zásaditý roztok lakmus červené fialové modré fenolftalein bezbarvé bezbarvé červeno-fialové
pH stupnice
- rozmezí hodnot 0 - 14
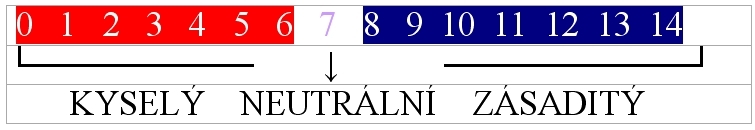
pH < 7 - roztok je kyselý
pH = 7 - roztok je neutrální
pH > 7 - roztok je zásaditý
Univerzální indikátor - směs různých barev
obr. Animovaná chemie - CD