




INVESTICE DO ROZVOJE VZDĚLÁVÁNÍ
Výukové materiály ZŠ Kaplice, Školní 226





- Elektrochemie
- Redoxní reakce
- Redoxní vlastnosti kovů
- Získávání kovů z rud
- Elektrolýza
- Galvanický článek
- Koroze
Elektrochemie
- část fyzikální chemie zabývající se rovnováhami a procesy v taveninách a roztocích elektrolytů při průchodu a vzniku elektrického proudu.
Redoxní reakce
Př. Hoření hořčíku

obr. Animovaná chemie - CD
2Mg0 + O20 ---> 2 MgII O-II
Redoxní reakce jsou reakce, při nichž se mění oxidační čísla.
Redoxní reakce je reakce spojená s přijímáním a odevzdáváním elektronů mezi reaktanty.
Každá redoxní reakce se skládá ze 2 poloreakcí: redukce a oxidace. Probíhají současně.
Každá změna ox. čísla souvisí s přesunem elektronů.
Redukce je děj, při kterém se oxidační číslo atomu prvku zmenšuje. Atom (částice) přijímá elektrony.
O20 ---> 2O-II
O 0 + 2e ---> O-II
2O0 + 4e ---> 2O-II
Oxidace je děj, při kterém se oxidační číslo atomu prvku zvětšuje. Atom (částice) ztrácí (odevzdává) elektrony.
Mg 0 ---> MgII
Mg 0 - 2e ---> Mg2+
2Mg 0 - 4e ---> 2Mg2+
Redukční činidlo
Redukční činidlo je látka obsahující atomy, které se při reakci oxidují (oxidační číslo těchto atomů se zvětšuje). Redukční činidlo způsobuje redukci jiných látek.
Ve zde uvedeném případě je redukčním činidlem hořčík Mg.
Oxidační činidlo
Oxidační činidlo je látka obsahující atomy, které se při reakci redukují (oxidační číslo těchto atomů se zmenšuje). Oxidační činidlo způsobuje oxidaci jiných látek.
Ve zde uvedeném případě je oxidačním činidlem kyslík O2
nahoru
Význam a příklady redoxních reakcí:
1. Základní životní děje (fotosyntéza, dýchaní)

obr. Animovaná chemie - CD
2. Elektrolýza je redoxní reakce probíhající na elektrodách při průchodu stejnosměrného el. proudu taveninou nebo elektrolytem.
obr. Animovaná chemie - CD
3. Redoxní reakce probíhají v galvanických článcích, které jsou zdrojem elektrické energie (např. suchý článek, olověný akumulátor).
obr. Animovaná chemie - CD
4. Koroze - redoxní reakce probíhají také při korozi kovů.
obr. Animovaná chemie - CD
5. Při výrobě kovů - redukce jejich oxidů
Např. redukce oxidu železa ve vysoké peci.
obr. Animovaná chemie - CD
nahoru
Redoxní vlastnosti kovů a nekovů
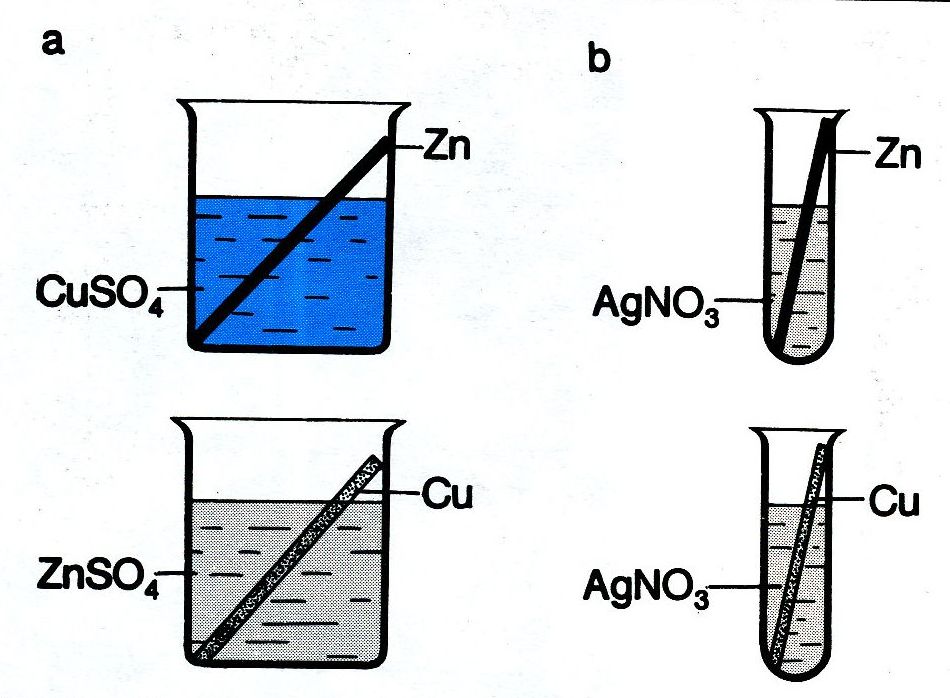
1. Vytěsňování kovů z roztoků jejich solí
obr. Základy chemie 2, Fortuna
CuSO4 + Zn ---> Cu + ZnSO4
ZnSO4 + Cu neprobíhá
2Ag NO3 + Zn ---> 2Ag + Zn( NO3)2
2Ag NO3 + Cu ---> 2Ag + Cu( NO3)2
Závěr: Schopnost vytěsňovat jiné kovy z roztoků klesá v řadě: Zn › Cu › Ag
2. Vytěsňování vodíku z kyseliny sírové
H2SO4 + Cu neprobíhá
H2SO4 + Fe ---> H2 + FeSO4
H2SO4 + Zn ---> H2 + ZnSO4
H2SO4 + Mg ---> H2 + MgSO4
Nejbouřlivěji reaguje s roztokem kyseliny hořčík, méně zinek, ještě méně železo.
Závěr: Podle reaktivity uspořádáme kovy: Mg › Zn › Fe ›› Cu
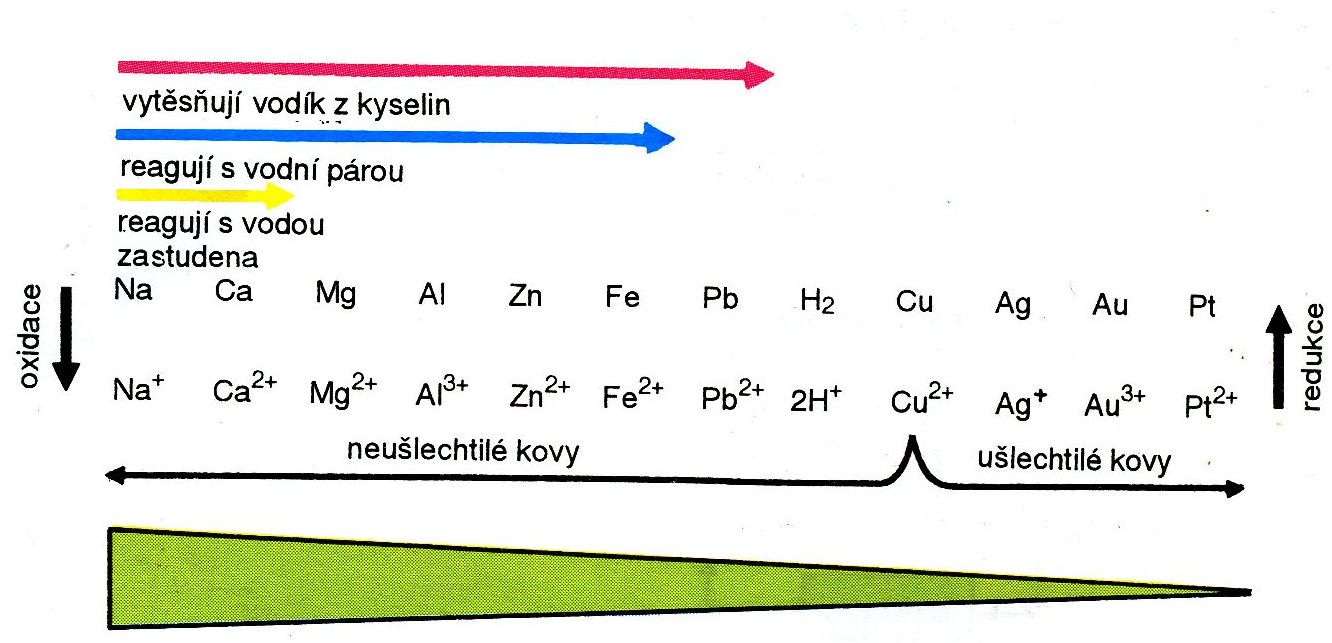
Řada reaktivity kovů (a vodíku)
Nejreaktivnější jsou kovy vlevo. Reaktivita klesá postupně zleva doprava:
obr. Základy chemie 2, Fortuna
Kovy zařazené vpravo od mědi se mohou v přírodě vyskytovat jako prvky a označují se jako ušlechtilé kovy. Ostatní kovy se v přírodě vyskytují ve sloučeninách.
Z postavení kovů v řadě reaktivity se dá odvodit, že:nahoru
- daný kov je schopen vytěsnit (vyredukovat) z roztoku všechny kovy umístěné v řadě reaktivity vpravo od něj (popřípadě i vodík);
- kov může být z roztoku své soli vytěsněn kterýmkoliv kovem umístěným v řadě reaktivity od něj nalevo.
Získávání kovů z rud
Rudy ---> sloučeniny (oxidy kovů) ---> kov
Přiklady rud:
Sfalerit (ZnS)
Př. Příprava Pb
Galenit (PbS)
Pyrit (FeS2)
Malachit (CuCO3)
1) úprava PbS: 2PbS + 3O2 ---> 2PbO + 2SO2
2) redukce PbO uhlíkem: 2PbO + C ---> CO2 + 2Pb
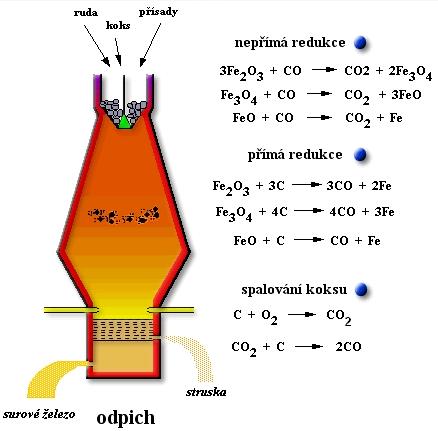
Výroba surového železa
Vsázka (suroviny) do vysoké pece:železná ruda: magnetit (Fe3O4), hematit (Fe2O3), limonit (Fe2O3 . n H2O), siderit (FeCO3)
koks - zdroj tepla a uhlíku, který redukuje železo
vápenec CaCO3 - struskotvorná přísada, chrání tekuté železo před oxidací
obr. Animovaná chemie - CD
obr. Animovaná chemie - CD
Složení a vlastnosti:Surové železo obsahuje asi 4% uhlíku a další prvky (křemík, fosfor, síra a příměsi kovů)
má velkou tvrdost, je křehké, není pružné ani kujné
Použití: topná tělesa, části strojů, potrubí, kuchyňské nádobí, výroba oceli
nahoru
Výroba oceli
obr. Animovaná chemie - CD
Výroba oceli spočívá ve snížení obsahu uhlíku (pod 1,7%), dále ve snížení obsahu Si, Mn, P oxidací vzdušným kyslíkem (tzv. zkujňování - spalování vzdušným kyslíkem)
Surovina: surové železo
Způsoby výroby oceli:a) v konvertorech
Vlastnosti: měkčí než surové železo, kujná
b) v nístějových pecích
c) v elektrických pecích
Použití: nástroje, stroje, různé konstrukce
nahoruElektrolýza
Elektrolýza - je redoxní děj probíhající na elektrodách při průchodu stejnosměrného elektrického proudu elektrolytem (roztok nebo tavenina obsahujicí volné pohyblivé ionty).
Průmyslově využití elektrolýzy:
a)Výroba kovů - Na, Al nekovů - Cl2, H2 sloučenin - NaOH
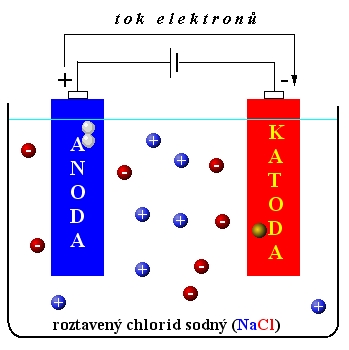
Př. Elektrolýza taveniny NaCl
NaCl ---> Na+ + Cl-
anoda (+)
Cl - - 1e ---> Cl oxidace
Cl + Cl ---> Cl2
katoda (-)
Na+ +1e ---> Na redukce
Celková reakce při elektrolýze taveniny NaCl:
2NaCl ---> 2Na + Cl2
obr. Animovaná chemie - CD
Př. Elektrolýza vodného roztoku NaCl
NaCl + H2O ---> Na+ + Cl- + H+ + OH-
anoda (+)
Cl- -1e ---> Cl oxidace
Cl + Cl ---> Cl2
katoda (-)
H+ +1e ---> H redukce
H + H ---> H2
V elektrolyzéru:
Na+ + OH- ---> NaOH
Celková reakce při elektrolýze vodného roztoku NaCl:
2 NaCl + 2 H2O ---> 2 NaOH + H2 + Cl2
b) Elektrolytické čištění kovů
obr. Základy chemie 2, Fortuna
Podobně jako měď lze elektrolyticky čistit i další kovy např. Fe, Zn, Ag, Au.
c) Galvanické pokovování - zvýšení odolnosti a zlepšení vzhledu povrchu
obr. Základy chemie 2, Fortuna
Pravidla galvanického pokovování
Pokovujeme-li předmět kovem X, použijeme:
předmět jako katodu
proužek kovu X jako anodu
roztok soli kovu X jako elektrolyt
nahoruGalvanický článek
obr. Základy chemie 2, Fortuna
Galvanický článek je zdroj stejnosměrného elektrického proudu, který se uvolňuje při redoxních reakcích.
Skládá se ze dvou elektrod a elektrolytu (látky schopné přenášet elektrický proud). Jedna z elektrod se oxiduje, druhá redukuje. Uvolněné elektrony odvádíme do spotřebiče, kde konají práci.
Napětí galvanického článku závisí na druhu elektrod a elektrolytu.
Galvanické články se děli na:
- a)neobnovitelné b)obnovitelné
a)Neobnovitelné
Př. Voltův článek
elektrody: Zn, Cu
elektrolyt: H2SO4
reakce:
anoda (-) oxidace Zn - 2e ---> Zn2+
katoda (+) redukce Cu2+ + 2e ---> Cu
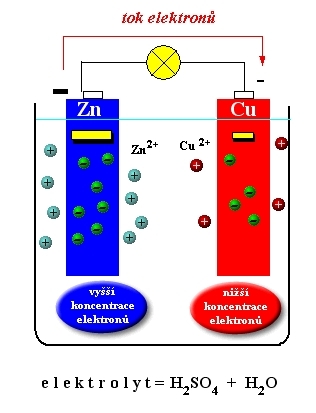
obr. Animovaná chemie - CD
Př. Danielův článek (mokrý článek)
Součásti článku:
Zn + ZnSO4
Reakce:
Cu + CuSO4
vodivá trubice s KNO3
voltmetr
oxidace Zn - 2e ---> Zn2+
redukce Cu2+ + 2e ---> Cu
Cu2+ + Zn ---> Cu + Zn2+
obr. Základy chemie 2, Fortuna
Př. Suchý článek (baterie)
Záporný pol: Zn
b) Obnovitelné (akumulátory - po vybití se dají znovu nabít)
Kladný pol: Uhlíková tyčinka + MnO2 (prášek)
elektrolyt: NH4Cl + ZnCl2
Elektroaktivní látka se vytváří při jejich nabíjení - probíhá elektrolýza
Př. Olověný akumulátor
Elektrolyt - kyselina sírová
Elektrody - desky upevněné na inertním nosiči (upravené do tvaru mřížky)
Pb
Pb + PbO2
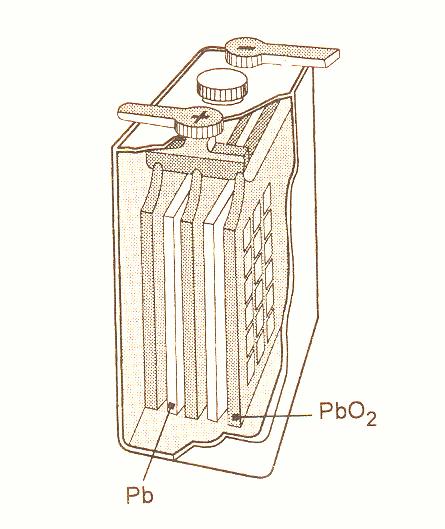
obr. Animovaná chemie - CD
Reakce:
vybíjení (chemická energie se mění na elektrickou energii)
Pb + PbO2 + 2H2SO4 ---> 2 PbSO4 + 2 H2O
nabíjení - reakce probíhá obráceně
Účinnost: 75-80%, (NiFe 55%)
Použití: v motorových vozidlech jako zdroj pro zapalování, osvětlení, servomotory a startér.
nahoru
Koroze - nepřítel kovů
Koroze kovů je redoxní reakce, která probíhá působením vzdušného kyslíku, vody a dalších látek (soli, kyseliny...). Agresivita prostředí (střídání teplot, intenzita slunečního záření atd.) ovlivňuje také průběh koroze.
Koroze může být:povrchová (př. měď, hliník)- kompaktní vrstvička oxidů nebo jiných sloučenin zamezí další korozi a chrání povrch kovu
Železo
celková (př. železo)- vrstvička oxidu není kompaktní, nechrání kov, koroze napadá celý objem
Rez, která vzniká při korozi železa je směs jeho oxidů a hydroxidů.

obr. Animovaná chemie - CD
Vznik hydroxidu:
4Fe + 3O2 + 6H2O ---> 4Fe(OH)3
Koroze železa na rozdíl od jiných kovů má destrukční účinky - postupně zničí kov v celém jeho objemu.
Měď
- koroze probíhá pouze na povrchu, měď se potáhne vrstvou hydratovaných oxidů zelené barvy, které měď chrání před další korozí.
Hliník, Zinek, Olovo, Cín,...
- tyto kovy podléhají pouze povrchové korozi za vzniku oxidů, které kov chrání před další korozí.
Ochrana proti korozi
a) mazání, olejování
- součástí strojů, automobilů apod.
b) nátěry, antikorozní nátěry
- laky nebo barvy - na povrchy konstrukcí apod.
c) smaltování
- povrch se pokrývá speciální látkou, která se vypálením zpevní a vytváří antikorozní vrstvu - nádobí
d) pokovování
- povrch oceli se pokryje vrstvou jiného kovu, který nepodléhá korozi (např. chrom) nebo který se pasivuje (např. zinek, nikl apod.). Zvláštním druhem je žárové stříkání kovů - tvz. METALIZOVÁNÍ
e) obětní elektroda
- část ocelové konstrukce, která nemůže být jinak chráněna, se vodivě spojí s elektrodou reaktivnějšího kovu (většinou zinkovou), která je postupně rozrušována namísto oceli. Elektroda se musí po čase vyměňovat.